Este post es para publicar el informe de trabajo de la tarea "Isótopos y Radiatividad". Se incluyen los informes realizados por los alumnos Kevin Díaz Hernández, de 3º B; Moana Kehres, de 3º C, y Miguel Acosta, de 3º A.
Mostrando entradas con la etiqueta Isótopos. Mostrar todas las entradas
Mostrando entradas con la etiqueta Isótopos. Mostrar todas las entradas
jueves, 9 de febrero de 2017
jueves, 2 de febrero de 2017
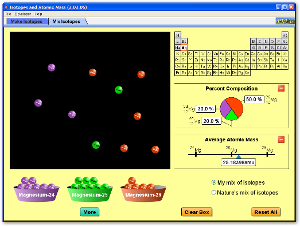
Simulación para el cálculo de la masa atómica
Cálculo de la masa atómica a partir de la masa isotópica y la abundancia relativa de los isótopos (descarga la aplicación)
También puedes acceder directamente a la aplicación
También puedes acceder directamente a la aplicación
domingo, 15 de enero de 2017
Simulaciones: Isótopos y RadiactivIdad
Las siguientes simulaciones te ayudarán a entender la radiactividad, los tipos de radiación, la energía de fisión y la energía nuclear.
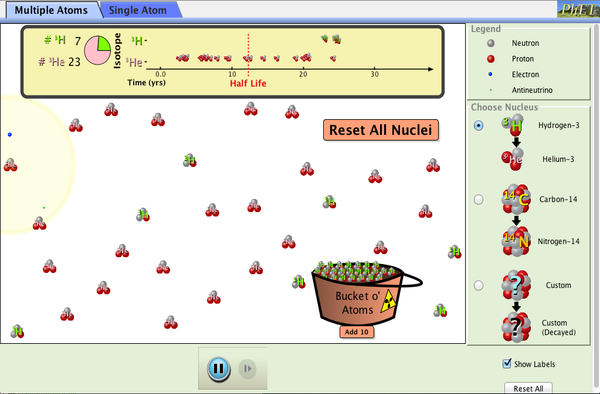
1.- Desintegración Beta
1.- Desintegración Beta
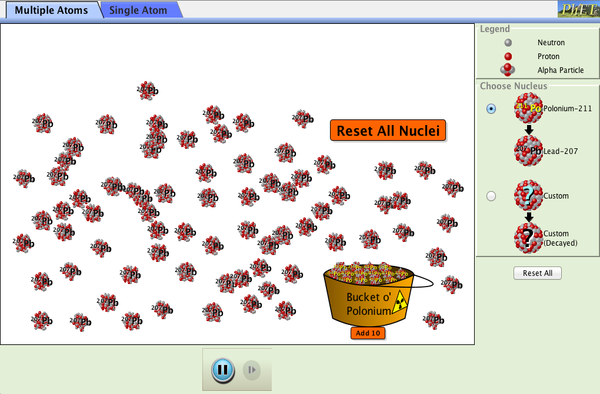
2.- La Radiación Alfa
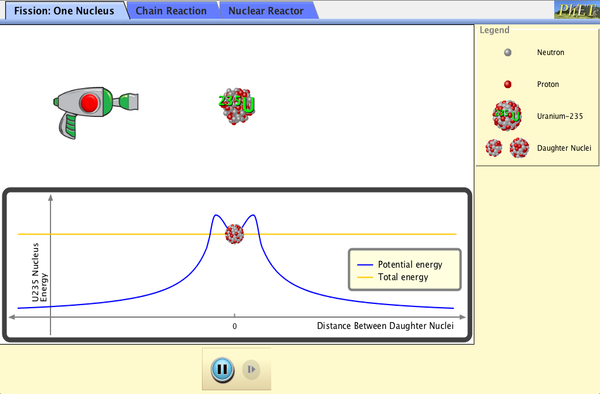
3.- La Fisión Nuclear
 4.- Explicación de la Radiactividad. Accede al enlace AQUÍ
4.- Explicación de la Radiactividad. Accede al enlace AQUÍ 5.- Ejemplo de radiactividad artificial. Accede al enlace AQUÍ
6.- La Energía Nuclear. Accede al enlace AQUÍ
Tarea 3.- Isótopos y radiactividad
Los isótopos, átomos de un mismo elemento, pueden ser naturales y artificiales. En el primer caso, se encuentran en la Tierra, y conocemos en torno a unos 300. Los isótopos artificiales son preparados u obtenidos en el laboratorios, al aumentar el número de neutrones del núcleo.
En esta tarea vas a hacer una pequeña investigación, siguiendo las distintas pautas, sobre los isótopos y las radiaciones. Son los isótopos inestables los que emiten radiación, aunque hay que tener en cuenta que el concepto de radiación es mucho más amplio. El objetivo es que conozcan los distintos tipos de radiación, de dónde proceden las llamadas radiaciones ionizantes, cuáles son unidades de medida, sus efectos perjudiciales para la salud, e incluso aplicaciones beneficiosas de las radiaciones ionizantes.
Procedimiento de trabajo: Accede al siguiente enlace:
http://rinconeducativo.org/contenidoextra/radiacio/teora_sobre_las_radiaciones.html
En él encontrarás, en cada link, la siguiente información:
1.- Nociones básicas sobre radiación.
2.- Radiación ionizante y no ionizante.
3.- Radiación ionizante natural y artificial.
4.- Detección y medida de las radiaciones ionizantes.
5.- Efectos biológicos de las radiaciones ionizantes.
6.- Protección radiológica.
7.- Energía nuclear.
8.- Aplicaciones de la radiación ionizante: aplicaciones médicas, aplicaciones industriales, aplicaciones en el arte y la conservación del patrimonio, aplicaciones medioambientales, aplicaciones agroalimentarias.
9.- Residuos radiactivos
Con la información que trabajes, haz un informe breve (a partir de un resumen) respondiendo a las siguientes cuestiones
1.- ¿Qué es radiación? ¿Tipos de radiación?
2.- Las radiaciones se clasifican en dos tipos. Indica, en el primer caso, cuáles son las radiaciones no ionizantes.
3.- Los átomos presentan isótopos estables e isótopos inestables. Estos últimos se transforman, y durante la transformación se libera una gran cantidad de energía en forma de radiaciones ionizantes, conociéndose a este fenómeno con el nombre de radiactividad. Explica los tres tipos de radiaciones ionizantes que existen.
4.- La radiaciones naturales es la radiactividad natural es la que existe en la naturaleza sin que el hombre haya influido. Fue descubierta por Henri Becquerel, en 1896.
La radiación natural que recibimos procede del espacio, del aire que respiramos, de los alimentos, del suelo y de los edificios. Las dosis de radiación se miden en Sievert y en rem, aunque el rem está en desuso (1 Sv= 100 rem).
a) Indica algunos isótopos que emita la Tierra.
b) El Rn-222 o 222Rn es un isótopo que puede acumularse en edificios. Explica esto.
c) El carbono tiene tres isótopos naturales, C-12 y C-13, que son estables, y el C-14, que es inestable. ¿Cómo se incorpora a los seres vivos el C-14?
5.- Las radiaciones tienen magnitudes y unidades. Indica cuáles son.
6.- Resume cuáles son los principales riesgos de las radiaciones ionizantes.
7.- Debido a los efectos perjudiciales de las radiaciones ionizantes se requiere protección radiológica. ¿Qué es y de qué tipo pueden ser)
8.- En las centrales nucleares se genera energía de fisión. Explica el origen de esta energía y por qué genera residuos radiactivos.
9.- Entre las múltiples aplicaciones de los isótopos radiactivos, elige una de ellas e indica en qué consiste su uso.
10.- Los residuos radiactivos de alta actividad son un grave problema. ¿Qué problemas genera y cómo se están solucionando?
En esta tarea vas a hacer una pequeña investigación, siguiendo las distintas pautas, sobre los isótopos y las radiaciones. Son los isótopos inestables los que emiten radiación, aunque hay que tener en cuenta que el concepto de radiación es mucho más amplio. El objetivo es que conozcan los distintos tipos de radiación, de dónde proceden las llamadas radiaciones ionizantes, cuáles son unidades de medida, sus efectos perjudiciales para la salud, e incluso aplicaciones beneficiosas de las radiaciones ionizantes.
Procedimiento de trabajo: Accede al siguiente enlace:
http://rinconeducativo.org/contenidoextra/radiacio/teora_sobre_las_radiaciones.html
En él encontrarás, en cada link, la siguiente información:
1.- Nociones básicas sobre radiación.
2.- Radiación ionizante y no ionizante.
3.- Radiación ionizante natural y artificial.
4.- Detección y medida de las radiaciones ionizantes.
5.- Efectos biológicos de las radiaciones ionizantes.
6.- Protección radiológica.
7.- Energía nuclear.
8.- Aplicaciones de la radiación ionizante: aplicaciones médicas, aplicaciones industriales, aplicaciones en el arte y la conservación del patrimonio, aplicaciones medioambientales, aplicaciones agroalimentarias.
9.- Residuos radiactivos
Con la información que trabajes, haz un informe breve (a partir de un resumen) respondiendo a las siguientes cuestiones
1.- ¿Qué es radiación? ¿Tipos de radiación?
2.- Las radiaciones se clasifican en dos tipos. Indica, en el primer caso, cuáles son las radiaciones no ionizantes.
3.- Los átomos presentan isótopos estables e isótopos inestables. Estos últimos se transforman, y durante la transformación se libera una gran cantidad de energía en forma de radiaciones ionizantes, conociéndose a este fenómeno con el nombre de radiactividad. Explica los tres tipos de radiaciones ionizantes que existen.
4.- La radiaciones naturales es la radiactividad natural es la que existe en la naturaleza sin que el hombre haya influido. Fue descubierta por Henri Becquerel, en 1896.
La radiación natural que recibimos procede del espacio, del aire que respiramos, de los alimentos, del suelo y de los edificios. Las dosis de radiación se miden en Sievert y en rem, aunque el rem está en desuso (1 Sv= 100 rem).
a) Indica algunos isótopos que emita la Tierra.
b) El Rn-222 o 222Rn es un isótopo que puede acumularse en edificios. Explica esto.
c) El carbono tiene tres isótopos naturales, C-12 y C-13, que son estables, y el C-14, que es inestable. ¿Cómo se incorpora a los seres vivos el C-14?
5.- Las radiaciones tienen magnitudes y unidades. Indica cuáles son.
6.- Resume cuáles son los principales riesgos de las radiaciones ionizantes.
7.- Debido a los efectos perjudiciales de las radiaciones ionizantes se requiere protección radiológica. ¿Qué es y de qué tipo pueden ser)
8.- En las centrales nucleares se genera energía de fisión. Explica el origen de esta energía y por qué genera residuos radiactivos.
9.- Entre las múltiples aplicaciones de los isótopos radiactivos, elige una de ellas e indica en qué consiste su uso.
Enlace: http://rinconeducativo.org/contenidoextra/radiacio/8aplicaciones_de_la_radiacin_ionizante.html
10.- Los residuos radiactivos de alta actividad son un grave problema. ¿Qué problemas genera y cómo se están solucionando?
domingo, 8 de enero de 2017
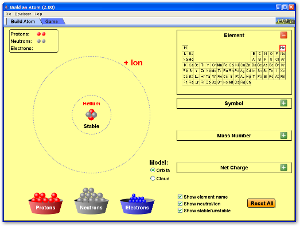
Simulaciones: modelos atómicos y construcción de átomos
MODELOS ATÓMICOS
CONSTRUIR ÁTOMOS
Con la siguiente animación podrás construir átomos. Sólo tienes que añadir protones, neutrones y electrones y comprobar si existe el átomo estable.
Con la siguiente animación podrás construir átomos. Sólo tienes que añadir protones, neutrones y electrones y comprobar si existe el átomo estable.
Tarea 2.- Consecuencias del modelo atómico de Rutherford: Númeroatómico, Número másico, Isótopos e Iones.
LEE Y ESTUDIA LAS PÁGINAS 40, 41, 42, 43, 44 y 45 DEL LIBRO. Haz un RESUMEN
Los átomos están formados por protones, neutrones y electrones, con una determinada estructura. Para estudiarlos vamos a definir los conceptos de número atómico y número másico.
A10.- ¿Qué hace a los átomos diferentes unos de otros? ¿A qué se llama número atómico? ¿A qué se llama número másico?
Un mismo elemento puede estar formado por isótopos diferentes.Los isótopos son aquellos átomos que tiene el mismo número másico pero diferente número másico
Cualquier átomo de un elemento puede representarse así: = . N= A ─ Z
A11.- Escribe los siguientes átomos en una columna:



Bajo cada átomo, en columnas separadas, escribe el número de protones, el número de protones más neutrones y el número de electrones que posee cada uno.
Los átomos están formados por protones, neutrones y electrones, con una determinada estructura. Para estudiarlos vamos a definir los conceptos de número atómico y número másico.
A10.- ¿Qué hace a los átomos diferentes unos de otros? ¿A qué se llama número atómico? ¿A qué se llama número másico?
Un mismo elemento puede estar formado por isótopos diferentes.Los isótopos son aquellos átomos que tiene el mismo número másico pero diferente número másico
Cualquier átomo de un elemento puede representarse así: = . N= A ─ Z
A11.- Escribe los siguientes átomos en una columna:



Bajo cada átomo, en columnas separadas, escribe el número de protones, el número de protones más neutrones y el número de electrones que posee cada uno.
A12.- Si un átomo neutro tiene 14 p+ y 14 n, indica sus números másico y atómico, así como el número de e-.
A13.- Completa la siguiente frase: el número atómico del cloro es 17, esto quiere decir que todos los átomos de cloro tienen............ protones y, si son electrónicamente neutros, tienen también....... electrones.
A14.- ¿Qué son los isótopos? Pon ejemplos. ¿Y qué son iones? Pon ejemplos
A15.- ¿Cuántos neutrones hay en cada uno de los isótopos del carbono que a continuación se representan? C-12 C-13 y C-14 (Z= 12)
A16.- Copia en el cuaderno y completa la siguiente tabla relativa a los 10 primeros elementos:
A13.- Completa la siguiente frase: el número atómico del cloro es 17, esto quiere decir que todos los átomos de cloro tienen............ protones y, si son electrónicamente neutros, tienen también....... electrones.
A14.- ¿Qué son los isótopos? Pon ejemplos. ¿Y qué son iones? Pon ejemplos
A15.- ¿Cuántos neutrones hay en cada uno de los isótopos del carbono que a continuación se representan? C-12 C-13 y C-14 (Z= 12)
A16.- Copia en el cuaderno y completa la siguiente tabla relativa a los 10 primeros elementos:
Elemento
|
Símbolo
|
Z
|
Nº electrones
|
Nº protones
|
A
|
Nº neutrones
|
Hidrógeno
|
1
|
1
|
||||
Helio
|
2
|
4
|
||||
Litio
|
3
|
7
|
||||
Berilio
|
4
|
9
|
||||
Boro
|
5
|
11
|
||||
Carbono
|
6
|
12
|
||||
Nitrógeno
|
7
|
14
|
||||
Oxígeno
|
8
|
16
|
||||
Flúor
|
9
|
19
|
||||
Neón
|
10
|
20
|
A17.- El níquel natural (Z= 28) está formado por cinco isótopos de números másicos: 58, 60, 61, 62 y 64. Escribe la notación simbólica de cada uno e indica su número de protones, neutrones y electrones.
A18.- Señala los iones que se originan en los siguientes procesos, indicando si serán aniones o cationes:
a) Se retiran dos e- a un átomo de magnesio. b) Se añaden dos – a un átomo de azufre
c) Se añade un e- a un átomo de bromo. d) Se retiran tres e- a un átomo de aluminio.
A19.- Señala el número de protones y electrones de los siguientes iones:  (Z= 20);
(Z= 20);  (Z= 9);
(Z= 9);  (Z= 13);
(Z= 13);  (Z= 8)
(Z= 8)
Suscribirse a:
Entradas (Atom)