Accede a las siguientes simulaciones interactivas para estufiar y aprender la tabla periódica Ihaz clic en en el enlace). Están en inglés.
domingo, 19 de febrero de 2017
UD3 Recursos para el proyecto "Adopta un elemento"
Vídeo: ¿Qué puedes aprender de la Tabla Periódica?
Vas a aprender cómo están organizados los elementos en la Tabla Periódica. En primer lugar, vas a ver un vídeo más entretenido que te ayudará a entender los grupos y periodos de la Tabla Periódica.
Actividad complementaria: Adopta un elemento
Objetivos
del trabajo:
- Adquirir los conceptos ligados a la estructura atómica y a la organización del sistema periódico.
- Adquirir autonomía en la búsqueda de información y en el uso de las TIC.
- Exponer los contenidos del trabajo (elemento adoptado). Y, si es posible, plantear la idea un proyecto común:to común: la creación de un mural de gran tamaño que represente el sistema periódico de los elementos.
¿Cómo lo vamos a hacer?
- Cada alumno/a tiene un elemento distinto.
- Se tiene que informar de las características del elemento químico que le haya tocado, en concreto tienes que tener anotado:
- EN UN FOLIO DEBES TENER LA SIGUIENTE INFORMACIÓN:
|
- Origen mitológico del nombre. En otros casos, el nombre del elemento tiene una historia relacionada con la mitología. Si es tu caso, usa esta tabla mitológica para averiguarlo.
- Origen del elemento. Indicar cómo se encuentra en la naturaleza y cómo se obtiene.
- Abundancia en la naturaleza y/o universo, si fuese posible
- Mencionar algunas aplicaciones del elemento.
- Año de descubrimiento.
Con una CARTULINA deberás recortar un cuadrado de 20 x 20 cm (ver figura):
|
- Colorear el símbolo del elemento químico dependiendo de su estado de agregación a 25ºC.
- Imprimir en color tu documento con la información de tu elemento químico en un folio de color que se te va a suministrar. Cada folio tiene un color diferente según las características del elemento que te haya tocado.
- Recortar el cuadrado con la información de tu elemento. Aproximadamente medirá 20x20 cm.
- En los tres cuadrados, que deben medir 6 x 6 cm, debes incluir una IMAGEN y/o INFORMACIÓN del elemento en ESTADO PURO, ORIGEN y USOS (el profesor te facilitará enlaces para obtener dicha información).
¿De qué color debo pintar el
símbolo del elemento? Dependiendo de su estado de agregación a 25ºC
(298K)
- AZUL MARINO si es líquido. Sólo son líquidos a esa temperatura Hg y Br
- ROJO si es gaseoso. Sólo son gaseosos a esa temperatura H, N, O, F, Cl, He, Ne, Ar, Kr, Xe y Rn
- SE QUEDA COMO ESTÁ (fondo blanco) si es desconocido: elementos de número atómico del 104 al 118
- NEGRO si es sólido. La mayoría de los elementos.
Si tu elemento es ....tu
CARTULINA será....
- Si tu elemento es un metal....AMARILLO PÁLIDO
- Si tu elemento es un NO metal.... ROSA PÁLIDO
- Si tu elemento es un semimetal o metaloide...VERDE PÁLIDO. Esta es la lista de los metaloides:
Recuerda que la cartulina debe
tener unos dimensiones de 20
x 20 centímetros.
Incorporar imágenes
y/o texto.
En los cuadros inferiores (Estado
puro, Origen y Usos)
tienes que buscar imágenes en la Red, ajustarlas al tamaño del
hueco y pegarlas en dichos huecos (SIN CAMBIAR LOS TAMAÑOS). También
puedes imprimir las imágenes en color, y pegarlas después. Puedes
expresarlo con palabras.
Tare 2 (II parte) La ordenación de los elementos y la tabla periódica (Lo que nos enseña la tabla periódica)
Es el momento de aprender y conocer toda la información que nos aporta la TABLA PERIÓDICA. Tenemos 118 elementos, de los cuales 90 naturales, Este año, 2017, se han aprobado los nombres para los elementos de número atómico 113, 115, 117 y 118.
Los elementos químicos están ordenados en la Tabla Periódica en orden creciente de número atómico, y dispuestos en 18 grupos o familias (las columnas) y 7 períodos (las filas). Generalmente cada grupo contiene elementos con el mismo número de electrones de valencia (en la última capa), lo que hace que tengan propiedades muy semejantes.
Los grupos más conocidos tienen nombres característicos: alcalinos, alcalino-térreos, térreos (grupo del boro), anfígenos (grupos del oxígeno), halógenos (grupo del flúor), gases nobles, etc.
En el siguiente enlace tienes una amplia información de la tabla periódica: http://www.ptable.com/?lang=es
A16.- Fíjate en la tabla periódica del dibujo superior. Indica el período y el grupo de la tabla en que colocarías los siguientes elementos, sin mirar la tabla: Manganeso, Mn (Z= 25); hierro, Fe (Z= 26), cobre, Cu (Z= 29);Cinc, Zn (Z= 30); níquel, Ni (Z= 28); galio, Ga (Z= 31); germanio, Ge (Z= 32); arsénico, As (Z= 33); bromo, Br (Z= 35); kriptón, Kr (Z= 36); titanio, Ti (Z= 22); cromo, Cr (Z= 24).
A17.- Observa la forma de la tabla periódica y contesta:
a) ¿Por qué crees que tiene una forma tan extraña, en lugar de ser una figura regular rectangular? ¿Por qué crees que aparece ese hueco en la parte superior?
b) Las dos filas que colocamos fuera, ¿dónde se colocarían si estuvieran dentro de la tabla periódica?
c) ¿Por qué el hidrógeno aparece situado a la izquierda y en la misma columna que los elementos litio, sodio, etc? ¿Tienes propiedades de esos elementos?
Una de las características de la Tabla Periódica es que las propiedades de los elementos varían de forma periódica. De ellas, sólo vamos a estudiar el carácter metálico.
El carácter metálico está relacionado con las propiedades físicas y químicas de los elementos. Este carácter disminuye a medida que nos desplazamos hacia la derecha por un período, y aumenta dentro de un grupo, hacia abajo. Según esto podemos distinguir tres familias: metales, no metales y semimetales.
A18.- Los elementos metales se agrupan en las familias 1 al 12 en los grupos alcalinos, alcalino-térreos y metales de transición. Indica los principales elementos de estos grupos.
A19.- Los elementos no metales están en los grupos del 14 al 18. Indica los nombres de estos grupos y sus principales elementos?
A20.- Hay un grupo de elementos semimetales o metaloides, que están en los grupos 13 al 17, en medio de metales y no metales. ¿Cuáles son estos elementos?
A21.- ¿En qué lado de la Tabla Periódica es más acentuado el carácter metálico: derecho o izquierdo? ¿Y quién tendrá carácter más metálico, el potasio o el cinc?
A22.- Resume las características de cada familia, metales, no metales y semimetales.
A23.- Consulta la tabla periódica y clasifica los siguientes elementos en metales, no metales y semimetales: bario, yodo, cobalto, nitrógeno, hierro, hidrógeno, germanio, plomo, cromo, bromo, arsénico, azufre, rubidio, cadmio y uranio.
A24.- Los elementos artificiales son los de número atómico 43, 61 y 93 en adelante. Localiza en la tabla periódica los elementos 43, 61, 93, 94, 95. 103 y 106 e indica sus nombres y símbolos.
Los elementos químicos están ordenados en la Tabla Periódica en orden creciente de número atómico, y dispuestos en 18 grupos o familias (las columnas) y 7 períodos (las filas). Generalmente cada grupo contiene elementos con el mismo número de electrones de valencia (en la última capa), lo que hace que tengan propiedades muy semejantes.
Los grupos más conocidos tienen nombres característicos: alcalinos, alcalino-térreos, térreos (grupo del boro), anfígenos (grupos del oxígeno), halógenos (grupo del flúor), gases nobles, etc.
En el siguiente enlace tienes una amplia información de la tabla periódica: http://www.ptable.com/?lang=es
A16.- Fíjate en la tabla periódica del dibujo superior. Indica el período y el grupo de la tabla en que colocarías los siguientes elementos, sin mirar la tabla: Manganeso, Mn (Z= 25); hierro, Fe (Z= 26), cobre, Cu (Z= 29);Cinc, Zn (Z= 30); níquel, Ni (Z= 28); galio, Ga (Z= 31); germanio, Ge (Z= 32); arsénico, As (Z= 33); bromo, Br (Z= 35); kriptón, Kr (Z= 36); titanio, Ti (Z= 22); cromo, Cr (Z= 24).
A17.- Observa la forma de la tabla periódica y contesta:
a) ¿Por qué crees que tiene una forma tan extraña, en lugar de ser una figura regular rectangular? ¿Por qué crees que aparece ese hueco en la parte superior?
b) Las dos filas que colocamos fuera, ¿dónde se colocarían si estuvieran dentro de la tabla periódica?
c) ¿Por qué el hidrógeno aparece situado a la izquierda y en la misma columna que los elementos litio, sodio, etc? ¿Tienes propiedades de esos elementos?
Una de las características de la Tabla Periódica es que las propiedades de los elementos varían de forma periódica. De ellas, sólo vamos a estudiar el carácter metálico.
El carácter metálico está relacionado con las propiedades físicas y químicas de los elementos. Este carácter disminuye a medida que nos desplazamos hacia la derecha por un período, y aumenta dentro de un grupo, hacia abajo. Según esto podemos distinguir tres familias: metales, no metales y semimetales.
A18.- Los elementos metales se agrupan en las familias 1 al 12 en los grupos alcalinos, alcalino-térreos y metales de transición. Indica los principales elementos de estos grupos.
A19.- Los elementos no metales están en los grupos del 14 al 18. Indica los nombres de estos grupos y sus principales elementos?
A20.- Hay un grupo de elementos semimetales o metaloides, que están en los grupos 13 al 17, en medio de metales y no metales. ¿Cuáles son estos elementos?
A21.- ¿En qué lado de la Tabla Periódica es más acentuado el carácter metálico: derecho o izquierdo? ¿Y quién tendrá carácter más metálico, el potasio o el cinc?
A22.- Resume las características de cada familia, metales, no metales y semimetales.
A23.- Consulta la tabla periódica y clasifica los siguientes elementos en metales, no metales y semimetales: bario, yodo, cobalto, nitrógeno, hierro, hidrógeno, germanio, plomo, cromo, bromo, arsénico, azufre, rubidio, cadmio y uranio.
A24.- Los elementos artificiales son los de número atómico 43, 61 y 93 en adelante. Localiza en la tabla periódica los elementos 43, 61, 93, 94, 95. 103 y 106 e indica sus nombres y símbolos.
La canción de la Tabla Periódica
En esta unidad estudiamos la Tabla Periódica de los elementos. Con los siguientes vídeos, podrás aprender a "querer" la tabla periódica de manera divertida. El primero está en inglés.
En este otro vídeo, realizado por un grupo de alumnas, podrás ver la creatividad a la hora de crear una canción sobre los elementos químicos.
Simulaciones pra construir atomos e iones, con la esctrutura electrónica
Tienes dos simulaciones para construir átomos. Solo tienes que definir el número de protones, neutrones y electrones, y éstos se organizarán en el núcleo, en el primer caso, y en la corteza, por capas o niveles, en el caso de los electrones.
Y la segunda simulación:
Tarea 2 La ordenación de los elementos químicos y la tabla periódica (I)
Los elementos están ordenados en la Tabla Periódica de acuerdo a como se distribuyen los electrones en las órbitas, alrededor del núcleo. Las órbitas constituyen niveles de energía o capas, en las que se distribuyen los electrones, ya que cada capa tiene un número determinado de electrones. La primera capa puede contener como máximo 2 electrones, la segunda capa 8, y la tercera otros 8.

Cada capa de electrones representa un período: en la primera hay dos electrones, porque solo hay dos elementos. En la segunda capa, el segundo período, hay 8 electrones, que corresponde, de manera consecutiva, a los 8 elementos de ese período (litio, berilio, boro, carbono, nitrógeno, oxígeno, flúor y neón).
En la tercera capa hay un máximo de 8 electrones, que corresponde, de igual manera, y consecutivamente, a los 8 elementos de ese período (sodio, magnesio, alumnio, silicio, fósforo, azufre, cloro y argón).
 A la última capa se le denomina capa de valencia. Como verás, todos los elementos que tienen los mismos electrones en la capa de valencia formarán
A la última capa se le denomina capa de valencia. Como verás, todos los elementos que tienen los mismos electrones en la capa de valencia formaránDe esta forma, para los 20 primeros elementos, la distribución de electrones por capa (estructura electrónica), será la siguiente:
A13.- Representa, usando modelo de capas, los electrones de los elementos que te indicará el profesor.
A14.- INVESTIGA: Los padres de la tabla periódica fueron el ruso D. Mendeleiev (1834-1907) y el médico alemán L. Meyer (1830-1895). Indaga sobre los criterios que estableció Mendeleiev para clasificar los elementos químicos.
A15.- Fue el británico Henry Moseley quien, en 1914, determino el número atómico de los elementos y creó las bases para la actual tabla periódica. ¿Cómo están ordenados hoy en día los elementos en la tabla periódica?
A14.- INVESTIGA: Los padres de la tabla periódica fueron el ruso D. Mendeleiev (1834-1907) y el médico alemán L. Meyer (1830-1895). Indaga sobre los criterios que estableció Mendeleiev para clasificar los elementos químicos.
A15.- Fue el británico Henry Moseley quien, en 1914, determino el número atómico de los elementos y creó las bases para la actual tabla periódica. ¿Cómo están ordenados hoy en día los elementos en la tabla periódica?
lunes, 13 de febrero de 2017
Vídeos: origen y abundancia de los elementos químicos
A continuación tienes una serie de vídeos que te ayudarán a entender el origen y la abundancia de los elementos químicos,
EL ORIGEN DE LOS ELEMENTOS QUÍMICOS (2.30 MIN)
EL ORIGEN DE LOS ELEMENTOS QUÍMICOS (estracto de un capítulo de la serie Cosmos, de Carl Sagan) (9.58 Min)
ABUNDANCIA DE ELEMENTOS QUÍMICOS EN EL CUERPO HUMANO(14.23 Min)
Recursos: abundancia de elementos químicos
Los elementos químicos están presentes en la naturaleza no de forma aislada, sino combinados con otros elementos. Las proporciones en que los podemos encontrar en la naturaleza puede variar, por ejemplo, un elemento que está abundante en la tierra no necesariamente lo estará en los seres vivos, es decir, no todos los elementos están presentes en la composición de los seres vivos. En el 99% del cuerpo de los organismos conocidos solo están presentes 6 de los elementos existentes en la tierra. El cuerpo humano, por ejemplo, está mayoritariamente conformado por los elementos de Carbono (C), Oxígeno (O), Hidrógeno (H), Nitrógeno (N), Fósforo (P) y Azufre (S). Por otro lado, si se compara la composición química de los seres vivos con la del medio físico, se puede notar que los principales elementos que componen a los seres vivos no son los que más abundan en la corteza terrestre (que no incluye ni a la atmósfera ni a los mares).
 | |||||
| Abundancia de elementos en la corteza terrestre |
 |
| Abundancia de elementos en los seres vivos |
jueves, 9 de febrero de 2017
Informe: Isótopos y radiactividad
Este post es para publicar el informe de trabajo de la tarea "Isótopos y Radiatividad". Se incluyen los informes realizados por los alumnos Kevin Díaz Hernández, de 3º B; Moana Kehres, de 3º C, y Miguel Acosta, de 3º A.
domingo, 5 de febrero de 2017
Documentación: ¿Cómo se calcula la masa atómica de un elemento?
Si accedes al enlaces podrás informarte de cómo se calcula la masa atómica de un elemento.

ENLACE CÓMO SE CALCULA LA MASA ATÓMICA
Te recuerdas que son tres formas:

ENLACE CÓMO SE CALCULA LA MASA ATÓMICA
Te recuerdas que son tres formas:
1.- Es la masa que consta en la tabla periódica de los elementos. La masa atómica, o sea la masa de un átomo o molécula dada, puede expresarse en unidades de masa del sistema internacional (SI): gramos, kilogramos, etc. Sin embargo, debido a que las masas atómicas expresadas en estos términos son increíblemente pequeñas, a menudo se expresan a través de unidades de masa atómica unificadas (generalmente se abrevia como "u" o "amu"). El estándar de una masa atómica equivale a 1/12 de la masa estándar de un isótopo de carbono-12. Las unidades de masa atómica indican la masa de un mol de un elemento o molécula dada en gramos. Es una propiedad muy útil a la hora de realizar cálculos práctico, ya que permite hacer fácilmente conversiones entre la masa y los moles de una cantidad dada de átomos o moléculas de un mismo tipo. (aún no hemos visto que es un mol)
2.- Podemos calcular la masa isotópica de un elmento. Es decir, la masa de un isótopo a partir del número de protones y neutrones de dicho isótopo.
3.- Se calcula la masa isotópica promedio como el valor medio de las masas isotópicas se gún la abundancia de los respectivos isótopos. También se pude denominar perso atómico.
3.- Se calcula la masa isotópica promedio como el valor medio de las masas isotópicas se gún la abundancia de los respectivos isótopos. También se pude denominar perso atómico.
jueves, 2 de febrero de 2017
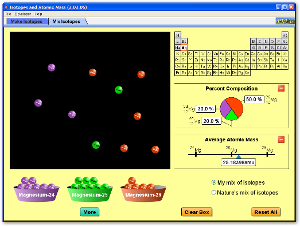
Simulación para el cálculo de la masa atómica
Cálculo de la masa atómica a partir de la masa isotópica y la abundancia relativa de los isótopos (descarga la aplicación)
También puedes acceder directamente a la aplicación
También puedes acceder directamente a la aplicación
Tarea 1 Los elementos quimicos: características y abundancia (UD 3)
UNIDAD 3.- LAS SUSTANCIAS QUÍMICAS: ELEMENTOS Y COMPUESTOS
Para esta tarea, debemos estudiar en el libro las páginas 48, 49, 50 y 51,
ACTIVIDAD PREVIA.- Lectura del texto y haz un resumen-esquema considerando los siguientes conceptos: masa atómica de un elemento, unidad de masa atómica, cálculo de la masa atómica a partir de las masas isotópicas y su abundancia, clasificamos los elementos (metales, no metales), abundancia relativa de los elementos (en el universo, la Tierra o los seres vivos)
HAZ LAS SIGUIENTES ACTIVIDADES EN TU CUADERNO
A1.- ¿Cómo podemos conocer la masa atómica de cualquier átomo, a partir de la definición de la unidad de masa atómica?
A2.- ¿A cuánto equivale en gramos, 1 u (unidad de masa atómica)?
A3.- ¿Cuántos átomos serán necesario para tener una cantidad de masa en gramos equivalente a la masa atómica? Si la respuesta es el número 6,022·1023, explica su significado.
A4.- ¿Cómo determinamos la masa atómica de un elemento a partir de las masas isotópicas y la abundancia relativa de sus isótopos.?
A5.- La plata existe en la naturaleza en dos isótopos de masas 107 u y 109 u. La abundancia relativa de cada uno es de 48,2% y 51,8%, respectivamente. Calcula la masa atómica de la plata.
A6.- El cobre existe en la naturaleza en dos isótopos de masas 63 y y 65 u. Si la masa atómica del Cu es 63,6 u, calcula la abundancia relativa de cada uno,
A7.- El litio tiene dos isótopos en la Tierra de números másicos 6 y 7 u, Sabiendo que la abundancia del primero es 7,42%, calcula su masa atómica.
A8.- Una primera clasificación de los elementos es agruparlos en metálicos y no metálicos. Indica sus diferencias atendiendo a las propiedades físicas de los elementos,
a) Si tienes una sustancia sólida que conduce la corriente eléctrica y que funde a altas temperaturas, ¿será metal o no metal?
A9.- Actualmente se conocen 118 elementos químicos, de los cuales 28 solo han sido sintetizados en laboratorio. Haz una clasificación de abundancia de los elementos químicos naturales
A10.- ¿Cuál es el elemento más abundante en el universo? ¿Y cuáles son los tres más abundantes en la Tierra? ¿Y en los seres vivos?
A11.- Investiga: intenta averiguar las razones por las que el oxígeno es el elemento más abundante, tanto en los seres vivos como en la corteza terrestre.
A12.- INVESTIGA: Observa la gráfica adjunta y trata de hacer un listado ordenado, de la abundancia relativa de los elementos en el universo. Responde:
a) ¿Hay alguna relación entre la abundancia y el número atómico?
b) La abundancia del hidrógeno, ¿a qué se debe?
c) ¿Cuál es el origen de los elementos? Investiga los diez primeros de la tabla periódica: He, Li, Be, B, C, N, O, F y Ne
Suscribirse a:
Entradas (Atom)