Este post es para publicar el informe de trabajo de la tarea "Isótopos y Radiatividad". Se incluyen los informes realizados por los alumnos Kevin Díaz Hernández, de 3º B; Moana Kehres, de 3º C, y Miguel Acosta, de 3º A.
Etiquetas
Mostrando entradas con la etiqueta Unidad 2. Mostrar todas las entradas
Mostrando entradas con la etiqueta Unidad 2. Mostrar todas las entradas
jueves, 9 de febrero de 2017
jueves, 26 de enero de 2017
El hierro, un elemento fundamental para el ser humano
Difeencia entre el hierro hemo y el hierro no hemo
¿Por qué el hierro animal se asimila mejor que el de los vegetales?
Ventajas del hierro de origen animal
Hierro de los alimentos vegetales
Los alimentos de origen vegetal contienen “hierro no hemo". Químicamente se representa como *Fe3+*. El hierro "no hemo" se tiene que transformar para poder formar glóbulos rojos.
Este hierro es más difícil de asimilar para el organismo y su absorción es menor. La vitamina C en forma de betacarotenos, ayudan a convertir el hierro de los vegetales en hierro hemo, aumentando así su absorción.
Por este motivo, en caso de anemia es importante combinar las legumbres, como las lentejas y los alimentos vegetales ricos en hierro, con fruta (por ejemplo, de postre) o ensaladas ricas en vitamina C.
Absorción del hierro animal y vegetal
Existe una gran diferencia entre la absorción del hierro según si este procede de alimentos de origen animal (30% absorción) o de origen vegetal (5% absorción).
Es natural que la absorción del hierro sea baja, porque este mineral es difícil de eliminar del organismo si se acumula. Por lo tanto, el cuerpo tiende a absorber poco hierro.
¿Cuáles son las funciones del hierro?
La canditdad de hierro en el cuerpo humano difiere del peso de la persona. Normalmente, oscila entre 2 y 4 g. El hierro es un elemento esencial para:
Accede al enlace: las lentejas y las características nutricionales
VÍDEO: EXTRAER EL HIERRO DE LOS CEREALES
El hierro está presente en los alimentos en dos formas, denominadas hierro hemo, en los animales, y hieero no hemo, en los vegerales. La diferencia principal entre el hierro que nos aportan los alimentos vegetales y los animales es que “el hierro de origen animal se absorbe mejor”. Esto es debido a que los alimentos de origen animal contienen "hierro hemo", es decir, la misma forma de hierro que se encuentra en nuestra sangre o que nuestro cuerpo utiliza para producir glóbulos rojos.
¿Por qué el hierro animal se asimila mejor que el de los vegetales?
Además de que los productos de origen animal contienen un tipo de hierro más asimilable ( hierro hemo), también se debe mencionar que *los alimentos de origen vegetal tienen componentes que disminuyen la absorción del hierro*.
Ventajas del hierro de origen animal
Como ya se ha mencionado, “el hierro que aportan los alimentos de origen animal se absorbe mejor que el hierro de los alimentos vegetales porque contienen hierro hemo”. Químicamente, el /hierro hemo /se representa como *Fe2+.
 |
| Grupo HEMO |
El hierro hemo es el que se utiliza para formar glóbulos rojos de la sangre. La absorción de este hierro es más alta que en los productos de origen vegetal, ya que a nivel intestinal también tenemos más mecanismos para absorerlo.
Los productos cárnicos, el pescado, huevo y marisco contienen hierro hemo. Los alimentos más ricos en hierro hemo son los elaborados con l as vísceras o la sangre de los animales ( patés, foie, morcilla, etc.). Los lácteos y los huevos, aunque son de origen animal, son pobres en hierro.
Hierro de los alimentos vegetales
Los alimentos de origen vegetal contienen “hierro no hemo". Químicamente se representa como *Fe3+*. El hierro "no hemo" se tiene que transformar para poder formar glóbulos rojos.
Este hierro es más difícil de asimilar para el organismo y su absorción es menor. La vitamina C en forma de betacarotenos, ayudan a convertir el hierro de los vegetales en hierro hemo, aumentando así su absorción.
Por este motivo, en caso de anemia es importante combinar las legumbres, como las lentejas y los alimentos vegetales ricos en hierro, con fruta (por ejemplo, de postre) o ensaladas ricas en vitamina C.
Absorción del hierro animal y vegetal
Existe una gran diferencia entre la absorción del hierro según si este procede de alimentos de origen animal (30% absorción) o de origen vegetal (5% absorción).
Es natural que la absorción del hierro sea baja, porque este mineral es difícil de eliminar del organismo si se acumula. Por lo tanto, el cuerpo tiende a absorber poco hierro.
¿Cuáles son las funciones del hierro?
La canditdad de hierro en el cuerpo humano difiere del peso de la persona. Normalmente, oscila entre 2 y 4 g. El hierro es un elemento esencial para:
- La formación de hemoglobina y ciertas enzimas
- Muchas proteínas y enzimas que mantienen una buena salud
- El transporte de oxígeno en la sangre a todas las partes del cuerpo
- Muchas reacciones metabólicas y la regulación del crecimiento y la diferenciación celular
- Actividad inmune
- Buen funcionamiento del hígado
- La protección contra las acciones de los radicales libres
Accede al enlace: las lentejas y las características nutricionales
VÍDEO: EXTRAER EL HIERRO DE LOS CEREALES
domingo, 15 de enero de 2017
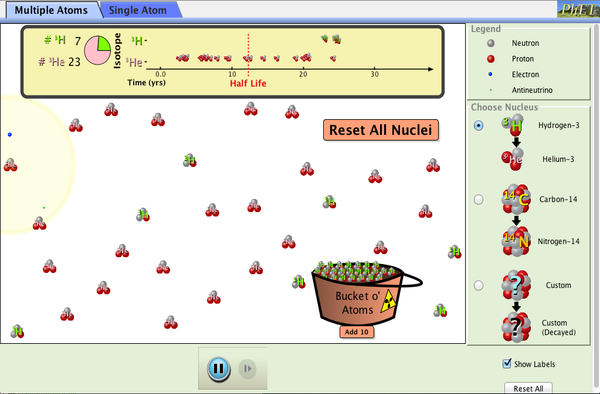
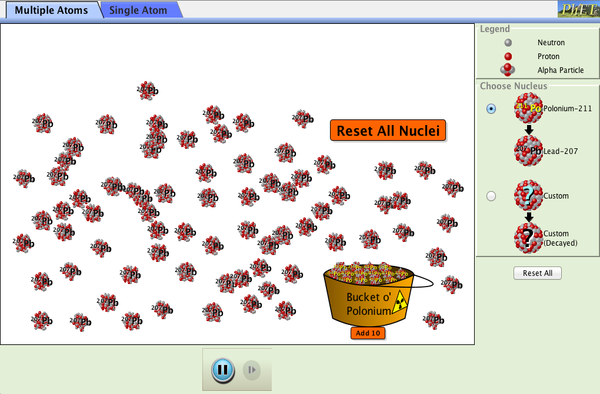
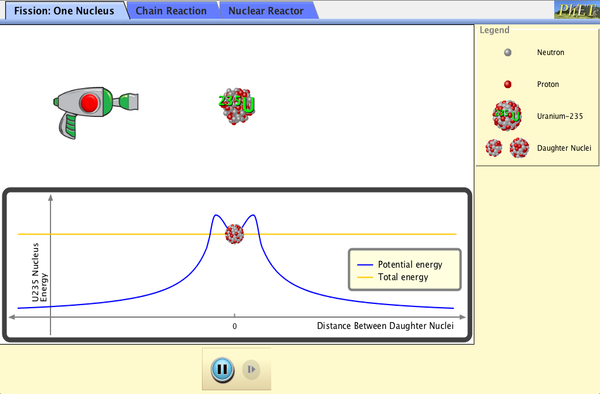
Simulaciones: Isótopos y RadiactivIdad
Las siguientes simulaciones te ayudarán a entender la radiactividad, los tipos de radiación, la energía de fisión y la energía nuclear.
1.- Desintegración Beta
1.- Desintegración Beta
2.- La Radiación Alfa
3.- La Fisión Nuclear
 4.- Explicación de la Radiactividad. Accede al enlace AQUÍ
4.- Explicación de la Radiactividad. Accede al enlace AQUÍ 5.- Ejemplo de radiactividad artificial. Accede al enlace AQUÍ
6.- La Energía Nuclear. Accede al enlace AQUÍ
Tarea 3.- Isótopos y radiactividad
Los isótopos, átomos de un mismo elemento, pueden ser naturales y artificiales. En el primer caso, se encuentran en la Tierra, y conocemos en torno a unos 300. Los isótopos artificiales son preparados u obtenidos en el laboratorios, al aumentar el número de neutrones del núcleo.
En esta tarea vas a hacer una pequeña investigación, siguiendo las distintas pautas, sobre los isótopos y las radiaciones. Son los isótopos inestables los que emiten radiación, aunque hay que tener en cuenta que el concepto de radiación es mucho más amplio. El objetivo es que conozcan los distintos tipos de radiación, de dónde proceden las llamadas radiaciones ionizantes, cuáles son unidades de medida, sus efectos perjudiciales para la salud, e incluso aplicaciones beneficiosas de las radiaciones ionizantes.
Procedimiento de trabajo: Accede al siguiente enlace:
http://rinconeducativo.org/contenidoextra/radiacio/teora_sobre_las_radiaciones.html
En él encontrarás, en cada link, la siguiente información:
1.- Nociones básicas sobre radiación.
2.- Radiación ionizante y no ionizante.
3.- Radiación ionizante natural y artificial.
4.- Detección y medida de las radiaciones ionizantes.
5.- Efectos biológicos de las radiaciones ionizantes.
6.- Protección radiológica.
7.- Energía nuclear.
8.- Aplicaciones de la radiación ionizante: aplicaciones médicas, aplicaciones industriales, aplicaciones en el arte y la conservación del patrimonio, aplicaciones medioambientales, aplicaciones agroalimentarias.
9.- Residuos radiactivos
Con la información que trabajes, haz un informe breve (a partir de un resumen) respondiendo a las siguientes cuestiones
1.- ¿Qué es radiación? ¿Tipos de radiación?
2.- Las radiaciones se clasifican en dos tipos. Indica, en el primer caso, cuáles son las radiaciones no ionizantes.
3.- Los átomos presentan isótopos estables e isótopos inestables. Estos últimos se transforman, y durante la transformación se libera una gran cantidad de energía en forma de radiaciones ionizantes, conociéndose a este fenómeno con el nombre de radiactividad. Explica los tres tipos de radiaciones ionizantes que existen.
4.- La radiaciones naturales es la radiactividad natural es la que existe en la naturaleza sin que el hombre haya influido. Fue descubierta por Henri Becquerel, en 1896.
La radiación natural que recibimos procede del espacio, del aire que respiramos, de los alimentos, del suelo y de los edificios. Las dosis de radiación se miden en Sievert y en rem, aunque el rem está en desuso (1 Sv= 100 rem).
a) Indica algunos isótopos que emita la Tierra.
b) El Rn-222 o 222Rn es un isótopo que puede acumularse en edificios. Explica esto.
c) El carbono tiene tres isótopos naturales, C-12 y C-13, que son estables, y el C-14, que es inestable. ¿Cómo se incorpora a los seres vivos el C-14?
5.- Las radiaciones tienen magnitudes y unidades. Indica cuáles son.
6.- Resume cuáles son los principales riesgos de las radiaciones ionizantes.
7.- Debido a los efectos perjudiciales de las radiaciones ionizantes se requiere protección radiológica. ¿Qué es y de qué tipo pueden ser)
8.- En las centrales nucleares se genera energía de fisión. Explica el origen de esta energía y por qué genera residuos radiactivos.
9.- Entre las múltiples aplicaciones de los isótopos radiactivos, elige una de ellas e indica en qué consiste su uso.
10.- Los residuos radiactivos de alta actividad son un grave problema. ¿Qué problemas genera y cómo se están solucionando?
En esta tarea vas a hacer una pequeña investigación, siguiendo las distintas pautas, sobre los isótopos y las radiaciones. Son los isótopos inestables los que emiten radiación, aunque hay que tener en cuenta que el concepto de radiación es mucho más amplio. El objetivo es que conozcan los distintos tipos de radiación, de dónde proceden las llamadas radiaciones ionizantes, cuáles son unidades de medida, sus efectos perjudiciales para la salud, e incluso aplicaciones beneficiosas de las radiaciones ionizantes.
Procedimiento de trabajo: Accede al siguiente enlace:
http://rinconeducativo.org/contenidoextra/radiacio/teora_sobre_las_radiaciones.html
En él encontrarás, en cada link, la siguiente información:
1.- Nociones básicas sobre radiación.
2.- Radiación ionizante y no ionizante.
3.- Radiación ionizante natural y artificial.
4.- Detección y medida de las radiaciones ionizantes.
5.- Efectos biológicos de las radiaciones ionizantes.
6.- Protección radiológica.
7.- Energía nuclear.
8.- Aplicaciones de la radiación ionizante: aplicaciones médicas, aplicaciones industriales, aplicaciones en el arte y la conservación del patrimonio, aplicaciones medioambientales, aplicaciones agroalimentarias.
9.- Residuos radiactivos
Con la información que trabajes, haz un informe breve (a partir de un resumen) respondiendo a las siguientes cuestiones
1.- ¿Qué es radiación? ¿Tipos de radiación?
2.- Las radiaciones se clasifican en dos tipos. Indica, en el primer caso, cuáles son las radiaciones no ionizantes.
3.- Los átomos presentan isótopos estables e isótopos inestables. Estos últimos se transforman, y durante la transformación se libera una gran cantidad de energía en forma de radiaciones ionizantes, conociéndose a este fenómeno con el nombre de radiactividad. Explica los tres tipos de radiaciones ionizantes que existen.
4.- La radiaciones naturales es la radiactividad natural es la que existe en la naturaleza sin que el hombre haya influido. Fue descubierta por Henri Becquerel, en 1896.
La radiación natural que recibimos procede del espacio, del aire que respiramos, de los alimentos, del suelo y de los edificios. Las dosis de radiación se miden en Sievert y en rem, aunque el rem está en desuso (1 Sv= 100 rem).
a) Indica algunos isótopos que emita la Tierra.
b) El Rn-222 o 222Rn es un isótopo que puede acumularse en edificios. Explica esto.
c) El carbono tiene tres isótopos naturales, C-12 y C-13, que son estables, y el C-14, que es inestable. ¿Cómo se incorpora a los seres vivos el C-14?
5.- Las radiaciones tienen magnitudes y unidades. Indica cuáles son.
6.- Resume cuáles son los principales riesgos de las radiaciones ionizantes.
7.- Debido a los efectos perjudiciales de las radiaciones ionizantes se requiere protección radiológica. ¿Qué es y de qué tipo pueden ser)
8.- En las centrales nucleares se genera energía de fisión. Explica el origen de esta energía y por qué genera residuos radiactivos.
9.- Entre las múltiples aplicaciones de los isótopos radiactivos, elige una de ellas e indica en qué consiste su uso.
Enlace: http://rinconeducativo.org/contenidoextra/radiacio/8aplicaciones_de_la_radiacin_ionizante.html
10.- Los residuos radiactivos de alta actividad son un grave problema. ¿Qué problemas genera y cómo se están solucionando?
domingo, 8 de enero de 2017
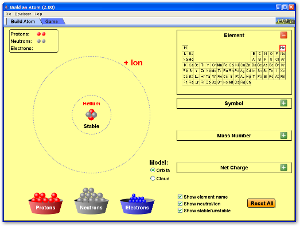
Simulaciones: modelos atómicos y construcción de átomos
MODELOS ATÓMICOS
CONSTRUIR ÁTOMOS
Con la siguiente animación podrás construir átomos. Sólo tienes que añadir protones, neutrones y electrones y comprobar si existe el átomo estable.
Con la siguiente animación podrás construir átomos. Sólo tienes que añadir protones, neutrones y electrones y comprobar si existe el átomo estable.
Tarea 2.- Consecuencias del modelo atómico de Rutherford: Númeroatómico, Número másico, Isótopos e Iones.
LEE Y ESTUDIA LAS PÁGINAS 40, 41, 42, 43, 44 y 45 DEL LIBRO. Haz un RESUMEN
Los átomos están formados por protones, neutrones y electrones, con una determinada estructura. Para estudiarlos vamos a definir los conceptos de número atómico y número másico.
A10.- ¿Qué hace a los átomos diferentes unos de otros? ¿A qué se llama número atómico? ¿A qué se llama número másico?
Un mismo elemento puede estar formado por isótopos diferentes.Los isótopos son aquellos átomos que tiene el mismo número másico pero diferente número másico
Cualquier átomo de un elemento puede representarse así: = . N= A ─ Z
A11.- Escribe los siguientes átomos en una columna:



Bajo cada átomo, en columnas separadas, escribe el número de protones, el número de protones más neutrones y el número de electrones que posee cada uno.
Los átomos están formados por protones, neutrones y electrones, con una determinada estructura. Para estudiarlos vamos a definir los conceptos de número atómico y número másico.
A10.- ¿Qué hace a los átomos diferentes unos de otros? ¿A qué se llama número atómico? ¿A qué se llama número másico?
Un mismo elemento puede estar formado por isótopos diferentes.Los isótopos son aquellos átomos que tiene el mismo número másico pero diferente número másico
Cualquier átomo de un elemento puede representarse así: = . N= A ─ Z
A11.- Escribe los siguientes átomos en una columna:



Bajo cada átomo, en columnas separadas, escribe el número de protones, el número de protones más neutrones y el número de electrones que posee cada uno.
A12.- Si un átomo neutro tiene 14 p+ y 14 n, indica sus números másico y atómico, así como el número de e-.
A13.- Completa la siguiente frase: el número atómico del cloro es 17, esto quiere decir que todos los átomos de cloro tienen............ protones y, si son electrónicamente neutros, tienen también....... electrones.
A14.- ¿Qué son los isótopos? Pon ejemplos. ¿Y qué son iones? Pon ejemplos
A15.- ¿Cuántos neutrones hay en cada uno de los isótopos del carbono que a continuación se representan? C-12 C-13 y C-14 (Z= 12)
A16.- Copia en el cuaderno y completa la siguiente tabla relativa a los 10 primeros elementos:
A13.- Completa la siguiente frase: el número atómico del cloro es 17, esto quiere decir que todos los átomos de cloro tienen............ protones y, si son electrónicamente neutros, tienen también....... electrones.
A14.- ¿Qué son los isótopos? Pon ejemplos. ¿Y qué son iones? Pon ejemplos
A15.- ¿Cuántos neutrones hay en cada uno de los isótopos del carbono que a continuación se representan? C-12 C-13 y C-14 (Z= 12)
A16.- Copia en el cuaderno y completa la siguiente tabla relativa a los 10 primeros elementos:
Elemento
|
Símbolo
|
Z
|
Nº electrones
|
Nº protones
|
A
|
Nº neutrones
|
Hidrógeno
|
1
|
1
|
||||
Helio
|
2
|
4
|
||||
Litio
|
3
|
7
|
||||
Berilio
|
4
|
9
|
||||
Boro
|
5
|
11
|
||||
Carbono
|
6
|
12
|
||||
Nitrógeno
|
7
|
14
|
||||
Oxígeno
|
8
|
16
|
||||
Flúor
|
9
|
19
|
||||
Neón
|
10
|
20
|
A17.- El níquel natural (Z= 28) está formado por cinco isótopos de números másicos: 58, 60, 61, 62 y 64. Escribe la notación simbólica de cada uno e indica su número de protones, neutrones y electrones.
A18.- Señala los iones que se originan en los siguientes procesos, indicando si serán aniones o cationes:
a) Se retiran dos e- a un átomo de magnesio. b) Se añaden dos – a un átomo de azufre
c) Se añade un e- a un átomo de bromo. d) Se retiran tres e- a un átomo de aluminio.
A19.- Señala el número de protones y electrones de los siguientes iones:  (Z= 20);
(Z= 20);  (Z= 9);
(Z= 9);  (Z= 13);
(Z= 13);  (Z= 8)
(Z= 8)
viernes, 9 de diciembre de 2016
Anexo: La materia se electriza (Tarea 1, UD 2)
Las siguientes simulaciones te ayudarán a entender por qué se electriza la materia. A las dos primeras simulaciones, accede haciendo clic sobre el enlace. La tercera puedes interactuar directamente sobre la imagen.
ELECTRICIDAD ESTÁTICA 1
ELECTRICIDAD ESTÁTICA 1
ELECTRICIDAD ESTÁTICA 2 (En Inglés)
ELECTRICIDAD ESTÁTICA 3 (En Inglés)
jueves, 24 de noviembre de 2016
UD2 Recursos para el estudio del átomo y de los modelos atómicos
Una lista de recursos para entender la estructura atómica.
ENLACES: Accediendo directamente al vínculo.
ENLACES: Accediendo directamente al vínculo.
LA TEORÍA ATÓMICA DE DALTON Y LAS LEYES PONDERALES: Animación flash del departamento de FYQ del IES Aguilar y Cano.
LAS TEORÍAS ATÓMICAS: Animación flash que explica las distintas teorias atómicas desde Dalton al modelo actual.
EL ATÓMO. Para entender la historia del átomo, los modelos atómicos, la estructura atómica y aplicar los conceptos de número atómico, número másico, masa atómica e isótopos.
LAS TEORÍAS ATÓMICAS: Animación flash que explica las distintas teorias atómicas desde Dalton al modelo actual.
EL ATÓMO. Para entender la historia del átomo, los modelos atómicos, la estructura atómica y aplicar los conceptos de número atómico, número másico, masa atómica e isótopos.
MODELOS ATÓMICOS. Para profundizar más en los modelos atómicos, desde Dalton hasta Bohr.
MODELOS ATÓMICOS (más información). Otro enlace para estudiar y entender los modelos atómicos.
MODELOS ATÓMICOS: HISTORIA : Un repaso por la historia de los modelos, con acceso a una simulación para construir átomos.
MODELOS ATÓMICOS (más información). Otro enlace para estudiar y entender los modelos atómicos.
MODELOS ATÓMICOS: HISTORIA : Un repaso por la historia de los modelos, con acceso a una simulación para construir átomos.
DESCUBRIMIENTO DEL ÁTOMO. ¿Cómo se descubrió la existencia del átomo? Aprende sobre el átomo y las partículas que la forman.
VIDEOS: Además, puedes ver este vídeo, aunque tenga un nivel alto, es importante que veas al menos hasta el modelo de Rutherford.
VIDEOS: Además, puedes ver este vídeo, aunque tenga un nivel alto, es importante que veas al menos hasta el modelo de Rutherford.
Otro VÍDEO sobre MODELOS ATÓMICOS
UD2 Estructura atómica de la materia. Tarea 1.- ¿Cómo podemos conocer la estructura del átomo? La historia de los modelos atómicos
LEE EL DOCUMENTO QUE PUEDES DESCARGAR AQUÍ. LUEGO RESPONDE:
A2.-
Enuncia
los tres principios fundamentales de la teoría atómica de Dalton.
A3.-
De
la teoría atómica de Dalton, destacamos tres conceptos, átomo,
elemento y compuesto. Definir
cada uno.


A4.-
Dalton dibujaba los compuestos con los átomos de los elementos
dispuestos simétricamente.. Representa en tu cuaderno el resto de
compuestos de la tabla empleando la simbología de Dalton.
| Nombre | Composición | Representación |
| Agua | Un átomo de oxígeno y dos de hidrógeno | |
| Amoniaco | Un átomo de nitrógeno y tres de hidrógeno | |
| Dióxido de carbono | Un átomo de carbono y dos átomos de oxígeno | |
| Óxido de dinitrógeno | Un átomo de oxígeno y dos de nitrógeno | |
| Trióxido de azufre | Un átomo de azufre y tres átomos de oxígeno | |
| Metano | Un átomo de carbono y cuatro de hidrógeno |

 Antes de continuar, descarga y trabaja el siguiente documento anexo: LA MATERIA SE ELECTRIZA
Antes de continuar, descarga y trabaja el siguiente documento anexo: LA MATERIA SE ELECTRIZACON EL DESCUBRIMIENTO DEL ELECTRÓN, SE PROPUSO EL MODELO ATÓMICO DE THOMSON
A5.- Thomson
descubrió el electrón en 1897 y en
1904 propuso un MODELO ATÓMICO. Posteriormente,
Rutherford descubriría el protón,
en 1918 partícula que tiene la misma carga que el electrón, pero
positiva, y su masa es 1840 veces mayor que la del electrón. Y en
1932, Chadwick descubriría el neutrón.
A6.- Para
describir
el interior del átomo, Thomson ideó un MODELO,
llamado de “pudín de ciruela”.
Descríbelo.
EL MODELO ATÓMICO
DE RUTHERFORD y de BOHR
A7.- En
1911 el científico inglés Ernest Rutherford (1887-1937) realizó un
experimento que permitió demostrar que la estructura del átomo no
era como lo decía Thomson. Con los datos de la observación
experimental, y sus conclusiones, Rutherford ideó un modelo atómico
que tuvo un gran éxito en la comunidad científica, y que aún hoy
en día seguimos utilizando para explicar las propiedades de los
átomos. Explica
el modelo atómico nuclear de Rutherford.
A8.- En
1913, el físico danés Niels Bohr, propuso un nuevo modelo, que en
1915 fue mejorado por Sommerfeld. Explica en qué consiste el modelo
atómico de Bohr.
A9.-
Después
de leer el texto, observa la tabla de la página 63. Completa:
| Partícula | Símbolo | Carga eléctrica | Masa | Año descubrimiento |
| Electrón | ||||
| Protón | ||||
| Neutrón |
lunes, 21 de noviembre de 2016
Unidad 2 Estructura Atómica de la Materia. Tarea 1: ¿Cómo podemos conocer la estructura del átomo? La historia de los modelos atómicos
ACTIVIDAD INICIAL.- Un viaje al interior de la materia: Las partículas que no vemos
Lectura del siguiente texto:
Si se mezclan volúmenes de garbanzos y arena, medidos en sendas probetas, el volumen final de la mezcla es menor que la suma de los volúmenes iniciales, porque las partículas de garbanzos y arena se acomodan rellenando huecos
2.- Si los átomos no son visibles con ningún microscopio tradicional, ¿por qué hoy en día la ciencia no duda de su existencia?
3.- ¿Quiénes fueron los que crearon el término “átomo”?
4.- ¿A que se debió que durante 2000 años no se creyese en la existencia de los átomos?
5.- ¿Puedes dividir un trozo de estaño indefinidamente en trozos más pequeños?
6.- ¿Cómo te imaginas qué es la materia por dentro? Haz un dibujo que lo represente.
7.- ¿Qué es un átomo? ¿Cómo son los átomos? ¿Son “bolitas” elementales sin estructura interna? Si no son elementales, ¿de qué están formados?
DOCUMENTO ANEXO: Las primeras ideas sobre la constitución de la materia: De Demócrito a la teoría atómica de Dalton
Lectura del siguiente texto:
Si se mezclan volúmenes de garbanzos y arena, medidos en sendas probetas, el volumen final de la mezcla es menor que la suma de los volúmenes iniciales, porque las partículas de garbanzos y arena se acomodan rellenando huecos
Igualmente,
al mezclar agua y alcohol, el volumen de la mezcla resultante es
menor que la suma de los volúmenes iniciales. El hecho es análogo
al anterior, aunque ahora las partículas no se ven.
Hay
otros fenómenos en la vida cotidiana que nos inducen a pensar que la
materia está compuesta por partículas.
Por ejemplo:
- Al añadir una gota de tinta, colorante o un cristal de permanganato de potasio con agua, la mancha coloreada se expande por todo el recipiente.
- Si se añade una pizca de sal a un vaso de agua, al poco tiempo cualquier parte del agua ha adquirido un sabor salado.
- Al destapar un frasco con perfume, el olor se extiende rápidamente por toda la habitación.
Los
fenómenos anteriores se interpretan fácilmente considerando que la
materia está constituida por partículas;
así, las partículas del cristal, el colorante o la sal se
distribuyen por todo el recipiente, las partículas de perfume se
dispersan por toda la habitación, las partículas de alcohol y agua
se entremezclan originando una mezcla con un volumen total menor.
Las
partículas citadas, constituyentes de la materia, son los átomos
o agrupaciones de algunos de ellos.
La materia está
constituida por partículas denominadas átomos. Su tamaño es del
orden de 10-10
m.
Debido a
su pequeño tamaño, los átomos no se pueden ver ni a simple vista
ni con un microscopio tradicional. Sólo con los llamados
microscopios de “efecto túnel” se pueden visualizar los átomos.
Las
primeras ideas sobre la constitución de la materia
El
concepto atómico de materia aparece en los escritos del griego
Demócrito (470-400 a.C.) basadas en las ideas de Leucipo. Sus ideas
ya definieron “los
átomos como eternos, indivisibles, homogéneos, incomprensibles y no
visibles”.
Además, sugirió que “los átomos se diferencian en forma, tamaño
y distribución geométrica”. Estas ideas no fueron admitidas en
aquella época.
Un
contemporáneo de Demócrito, Empédocles (490-430 a.C.) postuló que
la materia estaba formada por cuatro elementos: tierra,
agua, aire y fuego.
Sus ideas dominaron el pensamiento científico hasta el siglo XVIII,
gracias al impulso recibido de Aristóteles, otro filosofo griego
(384-322 a.C.), quien rechazó las ideas de Demócrito.
Sin
embargo, a lo largo del siglo XIX se fue aceptando la teoría
atómica:
los cuerpos materiales están constituidos por partículas
indivisibles llamadas átomos.
Responde
a las siguientes cuestiones
1.- ¿Cómo explicas que una gota de tinta en un vaso de agua acabe tiñendo toda el agua? 2.- Si los átomos no son visibles con ningún microscopio tradicional, ¿por qué hoy en día la ciencia no duda de su existencia?
3.- ¿Quiénes fueron los que crearon el término “átomo”?
4.- ¿A que se debió que durante 2000 años no se creyese en la existencia de los átomos?
5.- ¿Puedes dividir un trozo de estaño indefinidamente en trozos más pequeños?
6.- ¿Cómo te imaginas qué es la materia por dentro? Haz un dibujo que lo represente.
7.- ¿Qué es un átomo? ¿Cómo son los átomos? ¿Son “bolitas” elementales sin estructura interna? Si no son elementales, ¿de qué están formados?
DOCUMENTO ANEXO: Las primeras ideas sobre la constitución de la materia: De Demócrito a la teoría atómica de Dalton
Suscribirse a:
Entradas (Atom)